
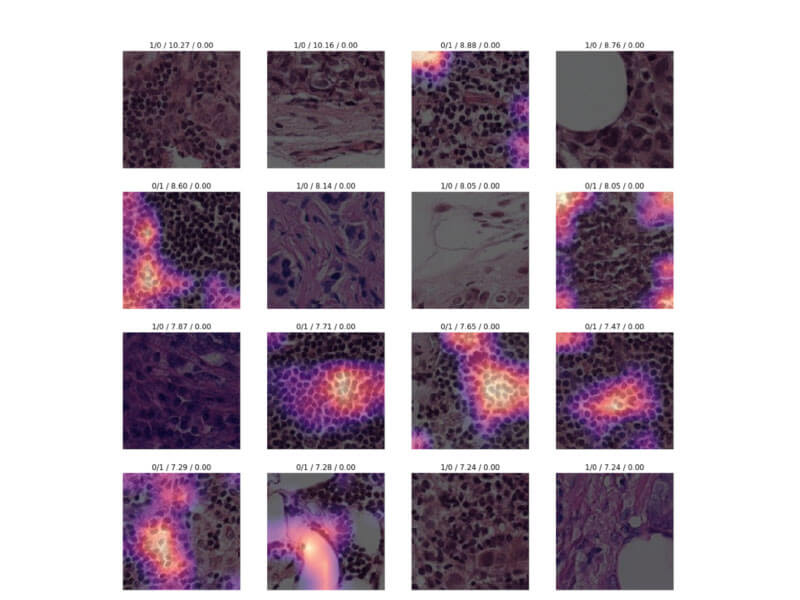
یکی از مهم ترین مراحل در تشخیص سرطان تشخیص سلول های سرطانی و مکان یابی سلول هاست.
حرکات سلولی سرنخ هایی از چگونگی تأثیر داروها یا انواع ژن ها بر گسترش تومورها در بدن ارائه می دهند. در نتیجه می توان به کمک فیلم های میکروسکوپی هسته سلول ها را ردیابی کرد. اما ردیابی سلول های سرطانی به صورت دستی کار دشواری است. پروژه ای که در این زمینه بررسی می کنیم توسط ژاکمیت، یک زیست شناس سلولی صورت گرفته است.
ژاکمیت به یک ماشین آموزش داد تا به جای او هسته های سلولی را دنبال کند. روش های استفاده شده در این پروژه برگرفته از پلتفرم ZeroCostDL4Mic بوده است؛ که بخشی از مجموعه منابع با هدف تسهیل استفاده از فناوری هوش مصنوعی (AI) برای دانشمندانی دارای حداقل تجربه برنامه نویسی می باشد.
فن آوری های هوش مصنوعی شامل چندین روش است. یکی از این روش ها، یادگیری ماشینی نام دارد که از داده هایی استفاده می کند که به صورت دستی پردازش شده و مطابق آنچه AI می آموزد پیش بینی می کند. در مقابل، یادگیری عمیق می تواند الگوهای پیچیده ای را در داده های خام شناسایی کند. که در اتومبیل های خودران، نرم افزارهای تشخیص گفتار، بازی های رایانه ای و همچنین برای یافتن هسته سلول در مجموعه داده های میکروسکوپی گسترده استفاده می شود.
منشا یادگیری عمیق به ١٩۴٠ بر می گردد. هنگامی که دانشمندان یک مدل رایانه ای با لایه های به هم پیوسته که مانند نورون های مغز انسان سازمان یافته بود، را طراحی کردند. چند دهه بعد، محققان به این “شبکه های عصبی” آموزش دادند تا شکل ها، کلمات و اعداد را شناسایی کنند. پس از کمتر از یک دهه، دیپ لرنینگ وارد دنیای زیست شناسی و پزشکی شد.
یکی از بزرگترین محرک های رشد دیپ لرنینگ در این عرصه، افزایش داده های زیستی بوده است. با استفاده از فناوری های جدید توالی ژنوم، یک آزمایش واحد می تواند چندین گیگابایت اطلاعات تولید کند. اطلس ژنوم سرطان (The Cancer Genome Atlas) ، که در سال ٢٠٠۶ راه اندازی شد، اطلاعاتی در مورد ده ها هزار نمونه از ٣٣ نوع سرطان را جمع آوری کرده است. این داده ها بیش از ۵/٢ پتابایت است (١ پتابایت معادل ١ میلیون گیگابایت است).
آنچه در این نوشته خواهیم داشت
بررسی پروفایل سلول
زیست شناس سرطان، نیل کاراگر نخستین گام را در این راستا در سال ٢٠٠۴ برداشت. در تحقیقات او نشان داده شده که هوش مصنوعی می تواند در فرایندهای غربالگری بهبود ایجاد کند. اما از طرفی به کارگیری هوش مصنوعی توسط زیست شناسان دشوار است. زیرا نیاز به آموزش کدنویسی خواهد داشت.
به همین دلیل تیم کاراگر به همراه یک تیم زیست شناس محاسباتی اقدام به بررسی اثرات داروهای متعدد بر روی سلول های سرطان سینه کردند. آن ها در ادامه با رنگ کردن سلول ها با رنگ فلورسنت و سپس استفاده از نرم افزار منبع باز CellProfiler برای تولید پروفایل سلول، روش خود را توسعه دادند.
سال گذشته همین گروه به بررسی چگونگی اثر دیپ لرنینگ بر بهبود این روند پرداختند. محققان داده های سرطان سینه Carragher را از مجموعه Broad Bioimage Benchmark بارگیری کرده و از آن برای آموزش یک شبکه عصبی عمیق که پیش از این فقط تصاویری مانند اتومبیل و حیوانات را دیده بود، استفاده کردند. با اسکن الگوهای موجود در داده های مربوط به سرطان سینه، این مدل آموزش دید تا تغییرات سلولی معنا دار را تشخیص دهد. از آنجایی که به این نرم افزار گفته نشده است که دقیقا دنبال چه باشد، ویژگی هایی را یافت که محققان حتی در نظر نگرفته بودند.
گروه دیگری از محققان به بررسی جهش های ژنتیکی پرداختند. آن ها با رنگ آمیزی سلول های سرطانی ریه را با استفاده از پروتکل Cell Painting رنگ آمیزی کرده و تفاوت اثر دارویی روی سلول ها را بررسی کردند. آن ها دریافتند که یادگیری ماشینی می تواند انواع معنی داری در تصاویر و همچنین فرآیندهای سنجش بیان ژن در سلول ها را شناسایی کند.
به عنوان بخشی از طرح مقدماتی نقشه سرطان، که شبکه های مولکولی موجود در سرطان انسان را ترسیم می کند، محققان در حال آموزش یک مدل دیپ لرنینگ برای پیش بینی واکنش های دارویی بر اساس توالی ژنوم سرطان هستند. چنین پیش بینی هایی حکم مرگ و زندگی را دارند و دقت آن ها بسیار مهم است.
برخی در برابر پذیرش نتایج به دست آمده مقاومت می کنند. چرا که سازوکارهای موجود در آن ها روشن نیست و شبکه های عصبی عمیق جواب ها را بدون آشکار کردن فرایند تولید می کنند. مشکلی که به عنوان “جعبه سیاه” شناخته می شود.
سیستم های مبنی بر یادگیری عمیق با تقلید از الگوهای فکری انسانی و از طریق الگوریتم شبکه های عصبی به تصمیم گیری و اجرای دستورات خاص میپردازند.
لایه های عصبی سیستم های دیپ لرنینگ توسط مهندسین طراحی و ساخته نمی شوند؛ بلکه این داده ها و اطلاعات مختلف هستند که موجب پیشرفت و بهبود فرایند یادگیری این الگوریتم ها میشوند.
دیپ لرنینگ در مکانیابی پروتئینها
یک گروه تحقیقاتی دیگر بر روی کاربرد دیپ لرنینگ در مکانیابی پروتئین مطالعه کردند. این کار بخشی از اطلس پروتئین انسانی است ، تلاشی چند ساله برای ترسیم پروتئین ها. اطلاعات مکانی نشان می دهند که پروتئین ها در کدام بخش سلول واقع شده اند. اگر محققان این اطلاعات را می دانستند، می توانستند از آن ها برای به دست آوردن بینش عمیق تر در زیست شناسی استفاده کنند.
این گروه تحقیقاتی از گیمرها جهت همکاری در به کارگیری کامپیوترها برای مکان یابی پروتئین ها در سلول، دعوت به عمل آورد. گیمرها در بازی EVE Online به منظور کسب امتیاز بیشتر می بایست پروتئین هایی که با فلوروسنت برچسب گذاری شده بودند را می یافتند. به همین منظور یک سیستم هوش مصنوعی که با همین هدف استفاده می شد را ارتقا بخشیدند.
سرانجام محققین تصاویر خود را به Kaggle بردند: پلتفرمی که کارشناسان یادگیری ماشین را به چالش می کشد تا بهترین مدل های خود را برای شکستن مجموعه داده های ارسال شده توسط شرکت ها و محققان توسعه بخشند.
در طی ٣ ماه، بیش از دو هزار تیم در سراسر جهان با هم به رقابت پرداختند؛ تا بتوانند یک مدل دیپ لرنینگ که قادر به تشخیص پروتئین و توزیع مکانی آن باشد را توسعه دهند. این پروژه ی چالش برانگیزی بود. نیمی از پروتئین های انسان در مکان های مختلفی در سلول ها یافت شدند؛. اما در هسته سلول ها تجمع بیشتری داشتند.
این الگوریتم تقریبا به اندازه متخصصان انسانی دقیق بود؛ اما سرعت و قابلیت تکثیر بیشتری داشت. علاوه بر این، می تواند اطلاعات مکانی را به صورت عددی بیان کند. وقتی بتوانیم اطلاعات را به شکل عددی بیان کنیم، یعنی می توانیم آن را با انواع دیگر داده ها ادغام کنیم. همین موضوع باعث تحول تحقیقات در زمینه سرطان گشته است.
آینده دیپ لرنینگ در مکان یابی سلولی
بسیاری از ابزارهای مورد نیاز برای ساختن مدل های دیپ لرنینگ بصورت آنلاین در دسترس هستند. از جمله چهارچوب های برنامه نویسی مانند TensorFlow ، Pytorch ، Keras و Caffe. محققانی که مایل تحقیق و مطالعه در زمینه مسائلی هستند که با ابزارهای تجزیه و تحلیل تصویر سر و کار دارند، می توانند از یک منبع آنلاین به نام Image Image Forum استفاده کنند.
سرویس ابری رایگان گوگل برای توسعه دهندگان هوش مصنوعی، دسترسی به چندین ابزار میکروسکوپی دیپ لرنینگ را فراهم می کند. هر آنچه نیاز داشته باشید ظرف چند دقیقه نصب می شود. با چند کلیک، کاربران می توانند از مثال های آماده برای آموزش یک شبکه عصبی استفاده کرده و سپس آن شبکه را بر روی داده های خود اعمال کنند. بدون نیاز به کدنویسی.
محققانی که می خواهند از مجموعه داده های بزرگتر استفاده کرده و یا مدل های پیچیده تری را آموزش دهند؛ ممکن است نیاز به منابع محاسباتی فراتر از سرویس رایگان گوگل داشته باشند.







آیا در حال حاضر کشور ما از این تکنولوژی دیپ لرنینگ برای تشخیص سرطان استفاده میکند یا خیر؟